A nem izom-invazív hólyagdaganat az orvostudományban elért haladás ellenére továbbra is rejtélyes probléma, amelynek nincs kézzelfogható megoldása az egyszeri kezelésre, mivel invazív felügyeletet igényel cisztoszkópia formájában. A diagnózissal, az ideális rezekciós technikával, a BCG-kezeléssel és a nyomon követéssel kapcsolatos kérdések merülnek fel. Ebben a cikkben áttekintjük a betegség diagnózisának legújabb fejleményeit, és ismertetjük az optimális kezelési stratégiákat1.
Előfordulás
A hólyagdaganat a negyedik leggyakoribb rákos megbetegedés a férfiak körében és a 10. leggyakoribb rákos megbetegedés a nők körében Észak-Amerikában [2]. Indiában a hólyagdaganat az ötödik leggyakoribb daganatos megbetegedés a férfiak körében a Delhiben található nyilvántartás szerint, az életkorral korrigált előfordulási arány 5,8/100 000 személyév [3]. A nőknél az előfordulási arány sokkal alacsonyabb, 1,5 eset/100 000 személy/év [3].
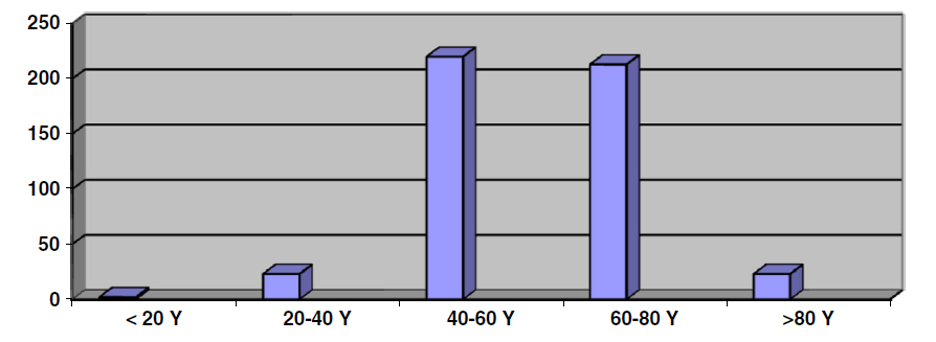
A hólyagdaganat az idősek betegsége, de egyre fiatalabbaknál is felfedezik ezt a betegséget [4] A betegség megjelenésekor az átlagéletkor 60 év (18-90 év) (1. ábra). A világirodalomban a férfiak és nők arányát 4:1-ben írták le, de az indiaiaknál ez túlnyomórészt a férfi lakosság betegsége, a férfiak és nők aránya 8,6:1 [5].
Nem izom-invazív hólyagdaganat
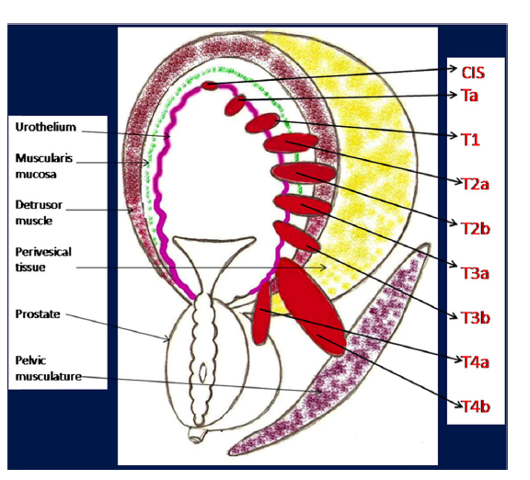
A hólyagdaganatok 90%-át a hólyagdaganat leggyakoribb változata az átmeneti sejtes carcinoma(szerintem ezt magyarul is tranzicionális sejtes karcinómának hívják) (TCC) [6, 7]. A detrusor izom érintettsége fontos mérföldkő a hólyagdaganat izom-invazív (T2 és több) és nem izom-invazív (NMIBC) (CIS, Ta és T1) osztályozásához 2. ábra, amely a hólyagdaganatok 75%-át teszi ki a megjelenéskor.
Klinikai megjelenés
Az NMIBC leggyakoribb megjelenési formája a durva hematuria. Többségüknél kezdetben mikroszkopikus hematuria jelentkezik, amely nem feltétlenül tüneti. Bár a mikroszkopikus hematuria kimutatására irányuló rutinszerű szűrés általában nem ajánlott, a magas kockázati tényezőkkel rendelkező férfiaknál, mint például a krónikus dohányosok és a kapcsolódó hajlamosító toxinok ipari dolgozói, szűrést kell végezni a mikroszkopikus hematuria kimutatására [8].
Az NMIBC egy másik jelentkezési módja az, hogy irritatív alsó húgyúti tüneteket, például gyakori vizelést és urget, valamint dysuriát okoz. Ritkán a betegek a húgycsőnyílás érintettsége miatt másodlagosan kialakuló hidronefrózis miatt ágyéki fájdalommal jelentkezhetnek.
Klinikai diagnózis
Ha felmerül a húgyhólyag rosszindulatú daganatának gyanúja, a klinikai diagnózis fő pillére a cisztoszkópos vizsgálat és a biopszia.
A képalkotás szerepe az NMIBC-ben
Az ultrahangvizsgálat a leggyakrabban végzett képalkotó eljárás, amely a hólyagban lévő kis papilláris elváltozást is felismerheti, és akár enyhe fokú hydroureteronephrosist is észlelhet. Bár a kontrasztanyaggal kiegészített számítógépes tomográfia (CECT) nem sok információt ad a daganat T-stádiumáról, de segít beazonosítani azon pácienseket, akiknél a hólyag valamint a máj-és nyirokcsomó áttétek (LN) eltávolítása szükséges [9]. Az MRI hasznos veseelégtelenség esetén és akkor, ha a beteg allergiás a kontrasztanyagra.
Az intravénás urográfia(IVU) , mely főként a vese és uréter daganatok esetén végeznek, rutinszerű alkalmazása hólyagrák esetén nem indokolt, , mivel a felső traktusban lévő szinkron elváltozás előfordulása nagyon alacsony, 1,8% [10, 11]. Jelenleg [12] a fluorodeoxiglükóz pozitronemissziós tomográfiát CT-vel kombinálva (FDG PET/CT) [12] számos rosszindulatú daganat esetében értékes, de egyelőre nem használható a hólyagdaganat stádiummeghatározására, mivel az FDG a vesén keresztül kiválasztódik a húgyutakba, ami akadályozza a képalkotást [13].
Vizelet citológia
Három, frissen ürített vizeletből származó mintát kell citológiára küldeni, amikor a hematuria alábbhagy.. Bár ez igen specifikus, a high grade kimutatására 90%,os érzékenységű, de low grade esetében 25 és 40% között van [12, 14]. A low grade hólyagrák végleges szövettani vizsgálata melletti pozitív citológia gondos nyomon követést tesz szükségesséa hólyagban vagy a felső traktus rejtett elváltozásai miatt.. A vizeletcitológia másik korlátja a patológusok közötti eltérések [15].
Fehér fény cisztoszkópia
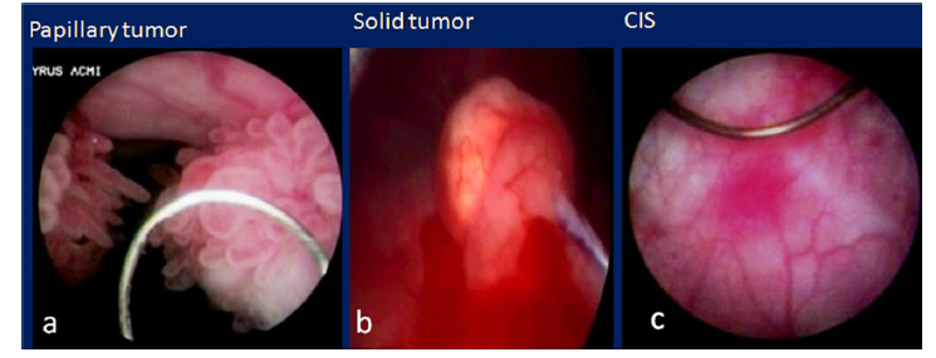
Az NMIBC különböző formákban jelenik meg:papillári solid, in situ carcinoma (CIS), amely lapos, bársonyos és vörös színű elváltozás (3. ábra).
Fluoreszcens cisztoszkópia és keskeny sávú képalkotás
Időnként a hagyományos fehérfényes cisztoszkópia nem vesz észre egy kis elváltozást vagy CIS-t. Az ilyen elváltozások jobb felismerése érdekében a fluoreszcens cisztoszkópiát és a keskeny sávú képalkotást alkalmazzák alternatívaként, ha a fehér fénycisztoszkópiával nem várható az elváltozás felismerésére. A hólyagba 5-aminolevulinsavat (5-ALA), a hem bioszintézisének előanyagát csepegtetik, amelyet a daganatos sejtek szelektíven felvesznek és protoporfirin IX-é alakítanak át. Ez a protoporfirin a kék fénnyel történő gerjesztés hatására a cisztoszkópon megfelelő szűrővel láthatóvá válik [16].
Sajnos a fluoreszcens cisztoszkópia alacsony specificitása miatt a gyulladásos elváltozásokban szenvedő betegeknél hamis pozitívitást mutat, különösen intravesicalis terápiák alkalmazása után. Ezért rutineljárásként nem ajánlott [4, 17].
Az NBI, ahol a két specifikus hullámhosszúságú fényt a nyálkahártya felszíni és mély rétegeinek kapillárisaiban lévő hemoglobin differenciáltan elnyeli, és különböző árnyalatokat bocsát ki, egyszerűen az ugyanabba a fehér fényrendszerbe épített fényforrás üzemmódváltásával elvégezhető. Bár randomizált vizsgálatok bizonyították előnyét, hogy további elváltozásokat tár fel, és 10%-kal csökkenti a kiújulási arányt, valódi előnye még nem látható [18]. Még mindig nem tudjuk, hogy a genetikai vagy mikroszkópos malignitás felismerése az amúgy normálisnak tűnő nyálkahártyán, vagy a fehér fényben nem látható kisebb tumor NBI általi felismerése változtatja meg inkább az eredményességet (4. ábra).
A hólyagdaganat transzurethralis rezekciója
A hólyagdaganat transzurethralis rezekciója nemcsak diagnosztikus, hanem terápiás céllal is a hólyagdaganat kezelésének kezdeti része. Miután a látható daganatot darabonként eltávolították, mély biopsziát vesznek a daganat ágyából, hogy dokumentálják a detrusor izom invázióját. A transzurethralis hólyag-rezekciójának (TURBT) ez a hagyományos technikája hiányos, mivel az esetek mintegy 30%-ában a detrusor izom kimaradhat a mintából. Ha a biopsziában nem azonosítható detrusor izom, vagy nem észlelhető izominvázió, a TURBT megismétlése 6-8 hét múlva javasolt [19].
Egy másik technika, a tumor en-bloc eltávolítása, ilyenkor jobb a detrusor izom fellelhetősége mintában, és bizonyítottan csökkenti a kiújulási arányt is [20].
A normális kinézetű hólyagváladék véletlenszerű biopsziája nem ajánlott, és csak a gyanús területeket, mint például a vörös, bársonyos foltokat,- amelyek a carcinoma in situ-ra utalnak, -biopsziázzák és külön küldik el szövettani vizsgálatra.
Azonnali intravesicalis mitomycin C instilláció
1. szintű bizonyíték van arra, hogy a mitomycin C perioperatív instillációja a hólyagtumor rezekcióját követő 6 órán belül hasznos a 3 cm-nél kisebb méretű szoliter papilláris tumor esetében [21]. Alkalmazásának elve az, hogy a TURBT helyén maradó mikroszkopikus daganatot és a hólyagban keringő sejteket, amelyek valószínűleg újra beágyazódnak, a mitomycin C elintézné. Bár a legtöbb irányelv ajánlja, gyakorlati alkalmazása nagyon korlátozott.
TURBT és a tumor stádiumbeosztása és osztályozása
A hólyagdaganat transzurethralis rezekcója után a végleges szövettan a daganatokat T-stádium és osztályok alapján osztályozza a további kezeléshez. A jelenleg követett tumorstádium az American Joint Committee on Cancer, más néven a tumor-nyirokcsomó-metasztázisok (TNM) osztályozása, amely a hólyagdaganat leggyakrabban használt stádiumbeosztási rendszere [22]. Jelenleg a stádiumbeosztási rendszer elsősorban a TURBT és a képalkotó eljárások eredményein alapul. A CIS magas fokú intraepiteliális neoplazma, amely a nyálkahártya lapos, erythemiás vagy “bársonyos” elváltozásaként jelentkezik. A CIS nagyon agresszív daganat, és a kezeletlen esetek akár 83%-ában hajlamos az invázióra való progresszióra [23]. A CIS legtöbbször magas fokú papilláris vagy szolid tumorral társul, de 3-5%-ban izoláltan is előfordulhat [24]. A fennmaradó Ta és T1 tumorok, amelyek az urotheliumra és a lamina propriaára korlátozódnak, az NMIBC 75%-át teszik ki.
Hasonlóképpen, a grade egy másik fontos prognosztikai tényező az NMIBC kiújulásának és progressziójának tekintetében. Hagyományosan a WHO 1973-as osztályozási rendszerét követték, amíg az Egészségügyi Világszervezet (WHO) és a Nemzetközi Urológiai Patológiai Társaság (ISUP) (WHO/ISUP) 1998-ban új stratégiát dolgozott ki a TCC három osztályba sorolására, megszüntetve a köztes fokozatot (2. fokozat), amely a WHO 1973-as osztályozásában vitatott volt 1. táblázat. Ezt 2004-ben tették közzé, és ma már a WHO osztályozási rendszere néven ismert [25].
TURBT utáni kezelés
Az Európai Rákkutatási és Kezelési Szervezet (EORTC) az NMIBC esetében kockázati tényezőket határozott meg a kiújulás és a progresszió szempontjából. Az egy Ta, a PUNLMP és a 3 cm-nél kisebb tumor alacsony kockázatúnak tekinthető. A carcinoma in situ, a T1, a magas fokú Ta, a többszörös daganat és a >3 cm-es tumorok magas kockázatú daganatok, a közepes kockázatúak pedig a Ta-T1 és az alacsony fokú daganatok. A kockázati kategóriától függően a kiújulás valószínűsége 5 év múlva 31, 46-62 és 78% az alacsony-közepes és magas kockázatú betegek esetében, az izom-invazív hólyagdaganat progressziója 5 év múlva 0,8, 6-17 és 45% [26]. A betegek különböző kockázati csoportokba történő besorolásához, valamint a kiújulás és a progresszió arányának kiszámításához elektronikus kalkulátor áll rendelkezésre a https://www.eortc.be/tools/bladdercalculator/ oldalon [27].
Sajnos a BCG-terápia dózisára és időtartamára vonatkozóan nincs konszenzus. Különböző sémák léteznek az 1-3 évig tartó fenntartó terápiára, de Indiában a legtöbb urológus hat dózis indukciós terápiát alkalmaz, és a kiújuláskor egy második indukciós terápiát adnak, ismét hat dózisban. A publikált randomizált vizsgálatok kritikus elemzései nem mutattak ki valódi előnyt a fenntartó terápiának a progressziómentes túlélésre [28].
A BCG-terápia segít a kiújulás 30-40%-os csökkentésében, de a 10 éves progresszióra gyakorolt hatására vonatkozó bizonyítékok gyengék [30]. Megfigyelték, hogy 6 hónapos BCG-terápia után nem valószínű, hogy a kiújulás csökkenésére van válasz; ezért a 6 hónapot olyan időszakként határozták meg, amely alkalmas az alacsonykockázatú NMIBC azonosítására, amely nem reagál a BCG-re [29]. A BCG-refrakter NMBIC-et úgy definiálják, hogy a betegség a BCG-t követően 6 hónap múlva is fennáll, a BCG-relapszus pedig a 6 hónapos betegségmentes állapot elérése utáni kiújulás [30].
A BCG-terápia nem mentes a szövődményektől, és a betegek 5%-a egyáltalán nem tolerálja a BCG indukciós terápiát. A mellékhatások a WHO I. fokozatú általános influenzaszerű tünetektől és a hólyagirritációs tünetektől a WHO III. fokozatú BCG-szepszisig terjedhetnek, amely teljes tuberkulózis elleni gyógyszeres kezelést igényel.
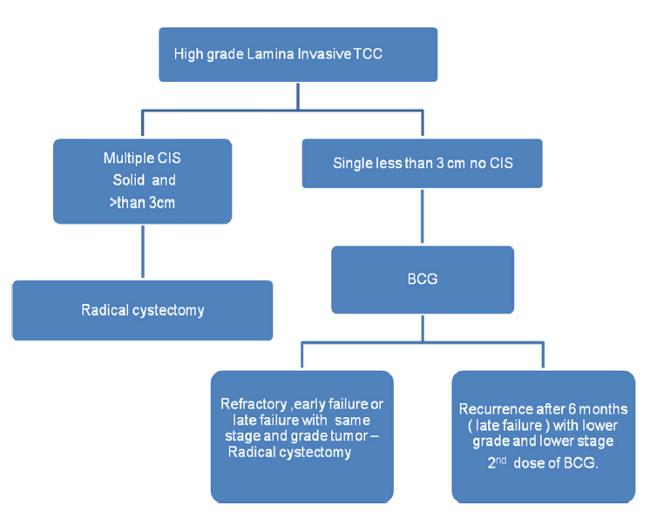
Az NMIBC legvitatottabb típusa a T1 magas fokú daganat. Ennek esetében sok urológus proaktív megközelítést alkalmaz radikális cisztektómiával és vizeleteltereléssel, de a legtöbben kezdetben BCG-terápiát adnának. Megfigyelték, hogy azoknál a betegeknél, akiknél a kezdeti BCG-terápia után gyorsan kiújul a betegség, megnő a MIBC-be való progresszió kockázata [30]. A nagy kockázatú NMIBC esetében a legjobb stratégia az lenne, ha a beteg kezdeti BCG-terápiában részesülne, majd, ha a követés során kiújulást vagy inváziót dokumentálnak, proaktív döntést hoznának a radikális cisztektómiáról[31] (5. ábra).
Nyomonkövető cisztoszkópia és a tumormarkerek szerepe
A betegeket az adjuváns kezelést követően rendszeresen nyomon kell követni. A standard ajánlás szerint a kezdeti 2 évben 3 havonta, a következő 2 évben 6 havonta, majd a következő 2 évben 6 havonta, majd élethosszig évente kell elvégezni a citológiát és a rendszeres cisztoszkópiát rugalmas vagy merev cisztoszkóppal. A cisztoszkópia invazív vizsgálat, és kellemetlenséget okoz a betegeknek, mivel helyi érzéstelenítésben történik, és a betegeknek rendszeres időközönként be kell jönniük a kórházba. Hasonlóképpen, a citológia nagyon alacsony érzékenységgel rendelkezik az alacsony fokú rákok kimutatására, a medián érzékenység mindössze 35%. Bár a specificitás magas (94%), a gyulladás jelenléte miatti hamis pozitív eredmények befolyásolhatják a döntést [32].
Törekvések történtek arra, hogy ezt az invazív cisztoszkópiás vizsgálatot különböző rák-specifikus markerek egyszerű vizeletvizsgálatával helyettesítsék. Vannak kereskedelmi forgalomban kapható markerek, mint a nukleáris mátrixfehérje 22 (NMP22) és a hólyagtumor antigén (BTA), más markerek mellett, mint a FISH, az immunocit, a telomeráz, a survivin és a fibrin lebomlási termék. Bár nagyobb az érzékenységük, mint a citológiáé, a specificitásuk nem magas; ezért annak ellenére, hogy több mint 30 markerrel rendelkeznek, egyetlen marker sem bizonyult olyan specifikusnak, amely kiválthatná a cisztoszkópiát [33].
Összefoglaló
A nem izom-invazív hólyagdaganat az orvostudomány fejlődése ellenére továbbra is rejtélyes probléma marad, amelynek egyszeri kezelésére nincs kézzelfogható megoldás, mivel invazív felügyeletet igényel cisztoszkópia formájában. A hólyagdaganatokkal kapcsolatos valódi kutatási területeket a diagnózissal, az ideális rezekciós technikával, a BCG-kezeléssel és a nyomon követéssel kapcsolatos kérdések jelentik.